Asam sulfat atau H2SO4 adalah senyawa kimia yang sangat korosif dan banyak digunakan dalam industri. Asam sulfat memiliki banyak manfaat, di antaranya adalah:
Dalam industri, asam sulfat digunakan sebagai katalis dalam reaksi kimia, elektrolit dalam baterai, dan bahan baku dalam produksi pupuk, pewarna, dan obat-obatan. Asam sulfat juga banyak digunakan dalam pengolahan air dan logam. Asam sulfat pertama kali ditemukan oleh ahli kimia Persia Jabir Ibn Hayyan pada abad ke-8.
Asam sulfat termasuk dalam golongan asam kuat. Asam sulfat dapat bereaksi dengan logam, basa, dan garam. Reaksi asam sulfat dengan logam menghasilkan gas hidrogen, sedangkan reaksi asam sulfat dengan basa menghasilkan garam sulfat. Asam sulfat juga dapat bereaksi dengan senyawa organik, seperti alkohol dan eter, untuk menghasilkan ester sulfat.
Asam Sulfat Rumus Kimia
Asam sulfat (H2SO4) adalah senyawa kimia yang sangat penting dan banyak digunakan dalam berbagai bidang industri. Berikut adalah 9 aspek penting terkait asam sulfat:
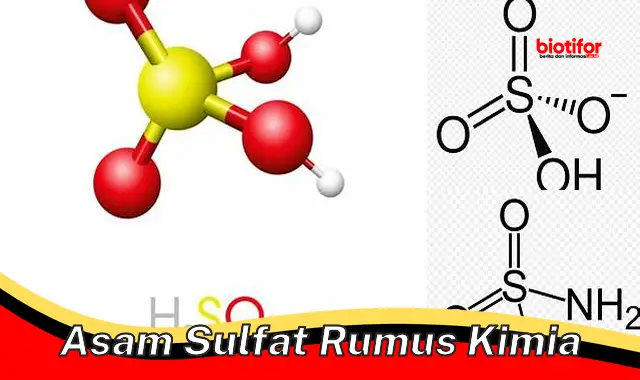
- Rumus kimia: H2SO4
- Nama sistematis: Asam sulfat
- Nama lain: Vitriol, minyak vitriol
- Titik lebur: 10 C
- Titik didih: 337 C
- Kelarutan dalam air: Sangat larut
- Keasaman: Asam kuat
- Korosif: Sangat korosif
- Penggunaan: Baterai, pupuk, obat-obatan
Asam sulfat memiliki sifat asam yang sangat kuat dan korosif. Asam sulfat dapat bereaksi dengan logam, basa, dan garam. Reaksi asam sulfat dengan logam menghasilkan gas hidrogen, sedangkan reaksi asam sulfat dengan basa menghasilkan garam sulfat. Asam sulfat juga dapat bereaksi dengan senyawa organik, seperti alkohol dan eter, untuk menghasilkan ester sulfat.
Asam sulfat banyak digunakan dalam industri, antara lain sebagai elektrolit dalam baterai, bahan baku dalam produksi pupuk, pewarna, dan obat-obatan, serta dalam pengolahan air dan logam.
Rumus kimia
Rumus kimia H2SO4 adalah rumus kimia untuk asam sulfat, senyawa kimia yang sangat penting dan banyak digunakan dalam berbagai bidang industri.
-
Komponen
Rumus kimia H2SO4 menunjukkan bahwa asam sulfat terdiri dari dua atom hidrogen (H), satu atom sulfur (S), dan empat atom oksigen (O).
-
Struktur
Struktur molekul asam sulfat berbentuk tetrahedral, dengan atom sulfur berada di pusat dan keempat atom oksigen berada di sudut-sudut tetrahedron. Dua atom hidrogen terikat pada dua atom oksigen.
-
Sifat
Asam sulfat adalah asam kuat dan korosif. Asam sulfat dapat melarutkan banyak logam dan senyawa organik. Asam sulfat juga bersifat higroskopis, artinya asam sulfat dapat menyerap air dari udara.
-
Kegunaan
Asam sulfat banyak digunakan dalam industri, antara lain sebagai elektrolit dalam baterai, bahan baku dalam produksi pupuk, pewarna, dan obat-obatan, serta dalam pengolahan air dan logam.
Rumus kimia H2SO4 sangat penting karena memberikan informasi tentang komposisi, struktur, sifat, dan kegunaan asam sulfat. Rumus kimia ini digunakan oleh para ilmuwan dan insinyur untuk mengembangkan dan menggunakan asam sulfat secara aman dan efisien.
Nama sistematis
Nama sistematis asam sulfat adalah asam sulfat, yang mencerminkan komposisi kimianya sebagai senyawa yang terdiri dari hidrogen, sulfur, dan oksigen. Nama ini penting karena memberikan informasi yang jelas dan tidak ambigu tentang identitas senyawa, memungkinkannya diidentifikasi dan dibedakan dari senyawa lain.
-
Komposisi kimia
Nama sistematis asam sulfat menunjukkan bahwa senyawa ini terdiri dari dua atom hidrogen (H), satu atom sulfur (S), dan empat atom oksigen (O), yang sesuai dengan rumus kimia H2SO4.
-
Struktur kimia
Nama sistematis asam sulfat tidak secara langsung menunjukkan struktur kimianya, tetapi rumus kimia H2SO4 menunjukkan bahwa asam sulfat memiliki struktur tetrahedral, dengan atom sulfur di pusat dan empat atom oksigen di sudut-sudut tetrahedron.
-
Sifat kimia
Nama sistematis asam sulfat tidak secara langsung menunjukkan sifat kimianya, tetapi rumus kimia H2SO4 menunjukkan bahwa asam sulfat adalah asam kuat dan korosif.
-
Kegunaan
Nama sistematis asam sulfat tidak secara langsung menunjukkan kegunaannya, tetapi rumus kimia H2SO4 menunjukkan bahwa asam sulfat banyak digunakan dalam industri, antara lain sebagai elektrolit dalam baterai, bahan baku dalam produksi pupuk, pewarna, dan obat-obatan, serta dalam pengolahan air dan logam.
Dengan demikian, nama sistematis asam sulfat, “asam sulfat”, dan rumus kimianya, “H2SO4”, saling terkait erat dan memberikan informasi penting tentang identitas, struktur, sifat, dan kegunaan senyawa ini.
Nama lain
Asam sulfat memiliki beberapa nama lain, di antaranya vitriol dan minyak vitriol. Nama-nama ini memiliki sejarah yang panjang dan mencerminkan sifat serta kegunaan asam sulfat.
Nama “vitriol” berasal dari kata Latin “vitreolum”, yang berarti “kaca”. Nama ini diberikan karena asam sulfat pekat memiliki tampilan seperti kaca ketika dingin. Nama “minyak vitriol” juga merujuk pada penampilan asam sulfat pekat yang menyerupai minyak.
Selain itu, nama “vitriol” juga digunakan untuk merujuk pada beberapa jenis garam sulfat logam, seperti vitriol biru (tembaga sulfat) dan vitriol hijau (besi sulfat). Hal ini menunjukkan bahwa asam sulfat merupakan komponen penting dalam pembuatan garam-garam sulfat logam.
Dengan demikian, nama lain asam sulfat, seperti vitriol dan minyak vitriol, memberikan informasi tentang sifat fisik dan kegunaan asam sulfat, serta hubungannya dengan garam-garam sulfat logam. Nama-nama ini masih digunakan hingga saat ini, meskipun nama sistematis “asam sulfat” lebih umum digunakan dalam konteks ilmiah.
Titik lebur
Titik lebur asam sulfat adalah 10 C. Artinya, pada suhu 10 C atau di bawahnya, asam sulfat akan berada dalam wujud padat, sedangkan pada suhu di atas 10 C, asam sulfat akan berada dalam wujud cair. Titik lebur ini merupakan sifat penting asam sulfat yang perlu diperhatikan dalam penggunaannya dan penyimpanannya.
-
Pengaruh suhu lingkungan
Titik lebur asam sulfat yang rendah menunjukkan bahwa asam sulfat mudah mencair pada suhu kamar. Hal ini perlu diperhatikan dalam penyimpanan dan penanganan asam sulfat, karena asam sulfat dapat mencair dan tumpah jika disimpan pada suhu yang terlalu tinggi.
-
Pembuatan es kering
Titik lebur asam sulfat yang rendah dimanfaatkan dalam pembuatan es kering. Es kering adalah karbon dioksida padat yang dibuat dengan mendinginkan karbon dioksida gas pada suhu yang sangat rendah, hingga berada di bawah titik leburnya. Asam sulfat digunakan sebagai pendingin dalam proses pembuatan es kering.
-
Reaksi kimia
Titik lebur asam sulfat dapat mempengaruhi laju reaksi kimia yang melibatkan asam sulfat. Pada suhu yang lebih tinggi, asam sulfat akan lebih reaktif karena molekul-molekulnya lebih aktif.
-
Korosi logam
Asam sulfat dapat menyebabkan korosi pada logam. Pada suhu yang lebih tinggi, laju korosi akan lebih cepat karena asam sulfat lebih reaktif.
Dengan memahami titik lebur asam sulfat, kita dapat menggunakan dan menyimpan asam sulfat dengan aman dan efektif. Kita juga dapat memanfaatkan sifat ini dalam berbagai aplikasi, seperti pembuatan es kering dan reaksi kimia.
Titik Didih
Titik didih asam sulfat adalah 337 C. Artinya, pada suhu 337 C atau di atasnya, asam sulfat akan berada dalam wujud gas, sedangkan pada suhu di bawah 337 C, asam sulfat akan berada dalam wujud cair. Titik didih ini menjadi salah satu sifat penting asam sulfat yang perlu diperhatikan dalam penggunaannya dan penyimpanannya.
-
Penguapan dan Pemanasan
Titik didih yang tinggi menunjukkan bahwa asam sulfat tidak mudah menguap pada suhu kamar. Hal ini penting diperhatikan dalam penyimpanan dan penanganan asam sulfat, karena asam sulfat tidak akan mudah menguap dan menyebar ke udara pada suhu kamar.
-
Destilasi
Titik didih asam sulfat yang tinggi dimanfaatkan dalam proses distilasi asam sulfat. Distilasi adalah proses pemisahan komponen suatu campuran berdasarkan perbedaan titik didihnya. Asam sulfat dapat dimurnikan dengan cara didistilasi untuk memisahkannya dari pengotor.
-
Korosi pada Logam
Asam sulfat dapat menyebabkan korosi pada logam. Pada suhu yang lebih tinggi, laju korosi akan lebih cepat karena asam sulfat lebih reaktif.
-
Reaksi Kimia
Titik didih asam sulfat dapat mempengaruhi laju reaksi kimia yang melibatkan asam sulfat. Pada suhu yang lebih tinggi, asam sulfat akan lebih reaktif karena molekul-molekulnya lebih aktif.
Dengan memahami titik didih asam sulfat, kita dapat menggunakan dan menyimpan asam sulfat dengan aman dan efektif. Kita juga dapat memanfaatkan sifat ini dalam berbagai aplikasi, seperti distilasi dan reaksi kimia.
Kelarutan dalam Air
Kelarutan asam sulfat dalam air sangat tinggi, menjadikannya salah satu sifat penting yang terkait dengan rumus kimianya (H2SO4).
-
Hidrasi
Ketika asam sulfat dilarutkan dalam air, ia mengalami proses hidrasi, di mana molekul-molekul air mengelilingi dan memisahkan ion-ion H+ dan SO42-. Proses ini melepaskan sejumlah besar panas, sehingga larutan asam sulfat menjadi panas.
-
Pembentukan Ion
Dalam larutan, asam sulfat terionisasi menjadi ion H+ dan SO42-. Ion-ion ini terlarut dalam air dan dapat bereaksi dengan zat terlarut lainnya, menjadikannya pelarut yang reaktif.
-
Aplikasi dalam Industri
Kelarutan asam sulfat yang tinggi dalam air membuatnya banyak digunakan dalam berbagai proses industri, seperti produksi pupuk, pewarna, deterjen, dan baterai.
-
Reaksi Kimia
Kelarutan asam sulfat dalam air memungkinkan terjadinya berbagai reaksi kimia. Asam sulfat dapat bereaksi dengan basa, logam, dan senyawa organik, menghasilkan berbagai produk.
Kelarutan asam sulfat yang sangat tinggi dalam air memiliki implikasi penting dalam penggunaan dan penanganannya. Sifat ini memungkinkan asam sulfat digunakan sebagai pelarut yang reaktif dan serbaguna, tetapi juga perlu diperhatikan potensinya untuk menyebabkan korosi dan masalah lingkungan.
Keasaman
Sifat asam sulfat sebagai asam kuat sangat berkaitan dengan rumus kimianya (H2SO4). Keasaman ini berperan penting dalam berbagai aspek, di antaranya:
-
Disosiasi Ion
Dalam larutan, asam sulfat terdisosiasi menjadi ion H+ dan SO42-. Ion H+ inilah yang memberikan sifat asam pada asam sulfat. Semakin tinggi konsentrasi ion H+, semakin kuat sifat asamnya.
-
Reaksi dengan Logam
Asam sulfat dapat bereaksi dengan logam, menghasilkan garam sulfat dan gas hidrogen. Reaksi ini menunjukkan sifat asam kuat asam sulfat yang dapat menggantikan logam dalam garamnya.
-
Reaksi dengan Basa
Asam sulfat dapat bereaksi dengan basa, menghasilkan garam sulfat dan air. Reaksi ini menunjukkan sifat asam kuat asam sulfat yang dapat menetralkan basa.
-
Penggunaan dalam Industri
Sifat asam kuat asam sulfat banyak digunakan dalam berbagai proses industri, seperti produksi pupuk, pewarna, dan deterjen.
Keasaman asam sulfat yang kuat merupakan salah satu sifat penting yang menjadikannya senyawa kimia yang sangat reaktif dan serbaguna. Sifat ini perlu diperhatikan dalam penggunaan dan penanganan asam sulfat untuk memastikan keamanan dan efektivitasnya.
Korosif
Sifat korosif asam sulfat sangat erat kaitannya dengan rumus kimianya (H2SO4). Sifat korosif ini berperan penting dalam berbagai aspek, di antaranya:
-
Reaksi dengan Logam
Asam sulfat dapat bereaksi dengan logam, menghasilkan garam sulfat dan gas hidrogen. Reaksi ini menunjukkan sifat korosif asam sulfat yang dapat merusak logam.
-
Penggunaan dalam Industri
Sifat korosif asam sulfat dimanfaatkan dalam berbagai proses industri, seperti pembersihan logam, etsa logam, dan produksi pupuk.
-
Bahaya bagi Kesehatan
Asam sulfat sangat korosif bagi kulit dan jaringan hidup lainnya. Kontak dengan asam sulfat dapat menyebabkan luka bakar dan kerusakan jaringan.
-
Penanganan dan Penyimpanan
Sifat korosif asam sulfat mengharuskan penanganan dan penyimpanan yang tepat. Asam sulfat harus disimpan dalam wadah yang tahan korosi dan ditangani dengan alat pelindung diri yang sesuai.
Sifat korosif asam sulfat perlu diperhatikan dalam penggunaan dan penanganannya. Sifat ini dapat berbahaya jika tidak ditangani dengan benar, tetapi juga dapat dimanfaatkan dalam berbagai aplikasi industri.
Penggunaan
Asam sulfat (H2SO4) memiliki peran penting dalam berbagai industri, termasuk baterai, pupuk, dan obat-obatan. Sifat-sifat unik asam sulfat, seperti keasamannya yang kuat, membuatnya sangat cocok untuk aplikasi ini.
Baterai
Asam sulfat digunakan sebagai elektrolit dalam baterai timbal-asam, yang banyak digunakan pada kendaraan bermotor dan aplikasi industri lainnya. Asam sulfat membantu menghasilkan arus listrik dengan bereaksi dengan timbal dan timbal dioksida di dalam baterai.
Pupuk
Asam sulfat digunakan dalam produksi berbagai macam pupuk, seperti amonium sulfat dan superfosfat. Pupuk ini sangat penting untuk meningkatkan hasil pertanian dan memenuhi permintaan pangan dunia yang terus meningkat.
Obat-obatan
Asam sulfat juga digunakan dalam produksi banyak obat-obatan, seperti aspirin dan paracetamol. Asam sulfat membantu menciptakan lingkungan asam yang diperlukan untuk sintesis beberapa obat, dan juga digunakan sebagai pengatur pH.
Memahami hubungan antara rumus kimia asam sulfat (H2SO4) dan penggunaannya dalam industri baterai, pupuk, dan obat-obatan sangatlah penting. Hal ini memungkinkan para ilmuwan dan insinyur untuk mengembangkan dan menggunakan asam sulfat secara efisien dan aman, berkontribusi pada kemajuan teknologi dan kesejahteraan manusia.
Pertanyaan Umum tentang Asam Sulfat (H2SO4)
Asam sulfat (H2SO4) adalah senyawa kimia penting dengan banyak kegunaan industri. Berikut adalah beberapa pertanyaan umum dan jawabannya tentang asam sulfat:
Pertanyaan 1: Apa rumus kimia asam sulfat?
Jawaban: Rumus kimia asam sulfat adalah H2SO4, yang menunjukkan bahwa senyawa ini terdiri dari dua atom hidrogen, satu atom sulfur, dan empat atom oksigen.
Pertanyaan 2: Apakah asam sulfat berbahaya?
Jawaban: Ya, asam sulfat sangat berbahaya dan korosif. Dapat menyebabkan luka bakar kimiawi pada kulit dan kerusakan jaringan hidup lainnya. Penting untuk menangani asam sulfat dengan hati-hati dan menggunakan alat pelindung diri yang sesuai.
Pertanyaan 3: Di mana asam sulfat digunakan?
Jawaban: Asam sulfat memiliki banyak kegunaan industri, termasuk dalam produksi baterai, pupuk, dan obat-obatan. Asam sulfat juga digunakan dalam pengolahan air dan logam.
Pertanyaan 4: Bagaimana asam sulfat diproduksi?
Jawaban: Asam sulfat diproduksi melalui proses yang disebut proses kontak, yang melibatkan oksidasi sulfur dioksida (SO2) menjadi sulfur trioksida (SO3). SO3 kemudian dilarutkan dalam air untuk menghasilkan asam sulfat.
Pertanyaan 5: Bagaimana cara menyimpan asam sulfat dengan aman?
Jawaban: Asam sulfat harus disimpan dalam wadah yang tahan korosi, jauh dari bahan yang mudah terbakar dan tidak kompatibel. Penting untuk mengikuti petunjuk keselamatan dan mengenakan alat pelindung diri yang sesuai saat menangani asam sulfat.
Pertanyaan 6: Apa dampak lingkungan dari asam sulfat?
Jawaban: Produksi dan penggunaan asam sulfat dapat menyebabkan dampak lingkungan, seperti emisi gas sulfur dioksida dan hujan asam. Penting untuk menerapkan praktik pengelolaan limbah yang tepat dan meminimalkan emisi untuk mengurangi dampak ini.
Memahami pertanyaan umum tentang asam sulfat ini penting untuk penggunaan dan penanganannya yang aman dan bertanggung jawab. Dengan mengikuti petunjuk keselamatan dan praktik pengelolaan lingkungan yang tepat, kita dapat memanfaatkan manfaat asam sulfat sambil meminimalkan risiko dan dampak negatifnya.
Artikel Terkait:
- Sifat Fisika dan Kimia Asam Sulfat
- Penggunaan Asam Sulfat dalam Industri
- Dampak Lingkungan dari Asam Sulfat
Tips Terkait Asam Sulfat (H2SO4)
Asam sulfat (H2SO4) adalah senyawa kimia yang banyak digunakan dalam industri. Berikut adalah beberapa tips penting terkait asam sulfat:
Tip 1: Penanganan yang Aman
Asam sulfat sangat korosif dan berbahaya. Selalu kenakan alat pelindung diri yang sesuai, seperti sarung tangan, kacamata pelindung, dan pakaian tahan bahan kimia, saat menangani asam sulfat.Tip 2: Penyimpanan yang Tepat
Simpan asam sulfat dalam wadah yang tahan korosi, tertutup rapat, dan berventilasi baik. Jauhkan dari bahan yang mudah terbakar dan tidak kompatibel.Tip 3: Pengenceran yang Hati-hati
Saat mengencerkan asam sulfat, selalu tambahkan asam ke dalam air, bukan sebaliknya. Proses ini akan menghasilkan panas, jadi lakukan secara perlahan dan bertahap.Tip 4: Pembuangan yang Bertanggung Jawab
Buang asam sulfat sesuai dengan peraturan setempat. Jangan membuangnya ke saluran pembuangan atau lingkungan.Tip 5: Pelatihan yang Memadai
Pastikan semua orang yang menangani asam sulfat telah menerima pelatihan yang memadai tentang sifat bahayanya dan prosedur penanganan yang aman.Tip 6: Inspeksi Berkala
Lakukan inspeksi berkala pada wadah dan peralatan penyimpanan asam sulfat untuk mengidentifikasi dan memperbaiki potensi kebocoran atau kerusakan.Tip 7: Penanggulangan Tumpahan
Ketahui prosedur penanggulangan tumpahan asam sulfat dan pastikan peralatan penanggulangan siap sedia. Segera netralkan tumpahan dengan bahan penyerap yang sesuai, seperti soda kue atau kapur.Tip 8: Pengetahuan tentang MSDS
Selalu tinjau Lembar Data Keselamatan Bahan (MSDS) untuk asam sulfat sebelum menangani atau menggunakannya. MSDS berisi informasi penting tentang sifat bahaya, tindakan pencegahan keselamatan, dan penanganan darurat.
Dengan mengikuti tips ini, Anda dapat meminimalkan risiko dan memastikan penanganan asam sulfat yang aman dan bertanggung jawab.
Kesimpulan:
Asam sulfat adalah senyawa kimia yang sangat berguna tetapi juga berbahaya. Dengan memahami sifat dan mengikuti prosedur penanganan yang tepat, kita dapat memanfaatkan manfaat asam sulfat sambil meminimalkan risiko kesehatan dan lingkungan.
Kesimpulan
Asam sulfat (H2SO4) adalah senyawa kimia penting yang banyak digunakan dalam berbagai industri. Rumus kimianya mencerminkan komposisi, struktur, sifat, dan kegunaannya. Asam sulfat memiliki sifat asam kuat dan korosif, serta sangat larut dalam air. Sifat-sifat ini membuatnya sangat reaktif dan serbaguna, tetapi juga perlu ditangani dengan hati-hati.
Penggunaan asam sulfat yang luas dalam industri meliputi produksi baterai, pupuk, obat-obatan, pengolahan air, dan logam. Namun, produksi dan penggunaannya juga dapat menimbulkan dampak lingkungan, sehingga diperlukan pengelolaan limbah yang tepat dan minimisasi emisi. Memahami sifat dan bahaya asam sulfat sangat penting untuk penanganan yang aman dan bertanggung jawab, serta untuk mengurangi risiko terhadap kesehatan manusia dan lingkungan.
Youtube Video:
